Analiza algorytmu diagnostycznego zakaźnego zapalenia otrzewnej kotów (FIP) w warunkach klinicznych z zastosowaniem RT-qPCR
Kocie koronawirusy są powszechnie występującymi patogenami w środowisku. Szczep FCoV I (enteropatogenny), o mniejszej zjadliwości, zazwyczaj powoduje łagodne biegunki lub przebiega bezobjawowo. Serotyp ten izolowany jest nawet u 90% populacji kotów. Najnowsze dane wskazują, że u ok. 12% nosicieli FCoV może dojść do mutacji FCoV I w obrębie białka kolca (M1058L, S1060A) oraz genu pomocniczego 3c. W wyniku tego procesu powstaje znacznie bardziej zjadliwy szczep FCoV II (fipogenny), który wykazuje zdolność do replikacji w makrofagach oraz monocytach, prowadząc do rozwoju zakaźnego zapalenia otrzewnej (5, 10). Dokładne mechanizmy powstawania owych mutacji nie są w pełni poznane (4).
FIP może przyjmować różne postacie kliniczne, w zależności od lokalizacji oraz kondycji układu odpornościowego kota. W grupie ryzyka znajdują się osobniki młode (do 3. roku życia), koty z obniżoną odpornością (np. w wyniku zakażenia wirusem FeLV lub FIV) oraz przebywające w dużych skupiskach i pod wpływem stresu (np. w schroniskach, hodowlach) (4, 5, 6, 9).
Zakaźne zapalenie otrzewnej manifestuje się w dwóch głównych postaciach: wysiękowej oraz bezwysiękowej.
Postać wysiękowa charakteryzuje się obecnością bogatobiałkowego wysięku w jamach ciała. Gromadzi się on w wyniku wydzielania przez zakażone wirusem monocyty lub makrofagi czynnika VEGF, który zwiększa przepuszczalność naczyń krwionośnych (8).
Dla postaci bezwysiękowej charakterystyczne są zmiany ziarniniakowe w narządach, powstające w wyniku wydzielania przez zakażone monocyty oraz makrofagi czynników zapalnych (1).
Objawy FIP w większości przypadków są nieswoiste i obejmują głównie apatię, spadek masy ciała, brak apetytu oraz długo utrzymującą się gorączkę niereagującą na leki.
W przypadku postaci wysiękowej FIP obserwuje się powiększenie obwodu jamy brzusznej w wyniku gromadzenia się wysięku, natomiast przy zajęciu klatki piersiowej może wystąpić duszność. Objawy postaci bezwysiękowej są dużo bardziej zróżnicowane, ponieważ mogą one obejmować rozmaite tkanki i narządy. Najczęściej pojawiają się problemy neurologiczne, np. zmiany zachowania, ataksja, drgawki, ślinotok (ryc. 1), oraz oczne, np. zapalenie błony naczyniowej oka, ciałka rzęskowego lub tęczówki czy anizokoria (ryc. 2).
Rzadziej występują objawy dermatologiczne (liczne drobne guzki lub grudki), ropno-ziarniniakowe zapalenie płuc, a także reno- i hepatomegalia (3, 7).
Biorąc pod uwagę zróżnicowany obraz kliniczny FIP oraz powagę tego schorzenia, kluczowe znaczenie ma szybka i trafna diagnostyka. W ostatnich latach to właśnie rozwój metod molekularnych umożliwił bardziej precyzyjne wykrywanie zakażeń. Celem niniejszej pracy jest analiza przydatności algorytmu diagnostycznego FIP, który integruje dane kliniczne i laboratoryjne z uwzględnieniem RT-qPCR jako jednego z głównych elementów decyzyjnych w warunkach rzeczywistej praktyki klinicznej.
Materiały i metody
Badaniu poddano 50 kotów z podejrzeniem zakaźnego zapalenia otrzewnej, skierowanych do diagnostyki w placówkach weterynaryjnych. U wszystkich zwierząt przeprowadzono badanie molekularne metodą RT-qPCR (Flash test) w celu wykrycia obecności materiału genetycznego szczepu FCoV II.
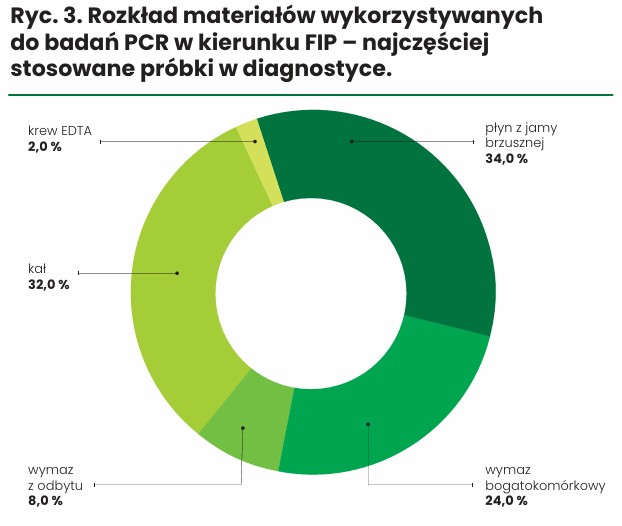
Materiał do badań pobierano z różnych źródeł, w zależności od dostępności i charakteru objawów klinicznych. Były to próbki płynu z jamy brzusznej, wymazy z odbytu, kał, bogatokomórkowe wymazy z dróg oddechowych oraz krew pobrana na EDTA (ryc. 3).
W przypadku FIP szczególne znaczenie mają parametry bezpośrednio wskazujące na stan zapalny lub dysfunkcje narządów. Zmiany w rutynowych badaniach hematologicznych oraz biochemicznych są niespecyficzne, ale istnieją pewne wzorce umożliwiające poparcie diagnozy.
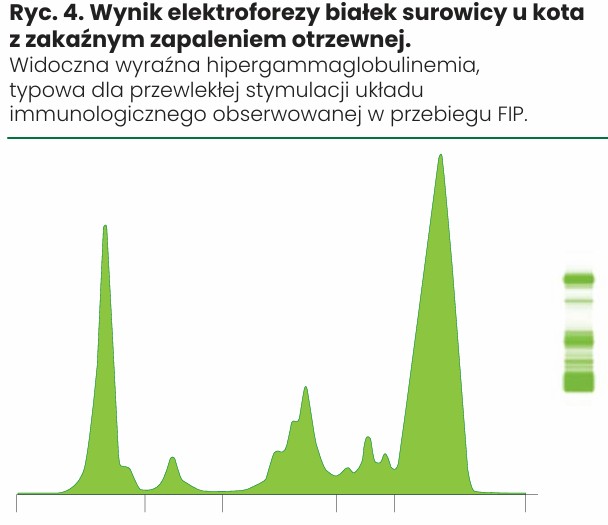
W morfologii krwi można zaobserwować leukocytozę związaną ze wzrostem liczby neutrofili oraz przewlekłą niedokrwistość nieregeneratywną. W badaniach biochemicznych najczęściej obserwuje się hipergammaglobulinemię z obniżonym stosunkiem albumin do globulin.
W celu szczegółowej oceny frakcji białek oraz zobrazowania ich wzajemnych proporcji wykonuje się elektroforezę białek surowicy (ryc. 4).

W przypadku, gdy stosunek A/G > 0,8, zakaźne zapalenie otrzewnej jest mało prawdopodobne. Kolejnym dość częstym objawem jest hiperbilirubinemia, szczególnie w postaci wysiękowej FIP. Podwyższenie stężenia bilirubiny całkowitej w surowicy często obserwowane jest bez równoczesnego wzrostu aktywności enzymów wątrobowych. Najprawdopodobniej wynika to ze zwiększonej degradacji krwinek czerwonych i problemów z metabolizmem produktów rozpadu hemoglobiny (2, 6, 7).
W przypadku wystąpienia wysięku warto wykonać próbę Rivalty. Umożliwia ona rozróżnienie przesięku od wysięku. Wysięk FIP charakteryzuje się lepką konsystencją i żółtym zabarwieniem. W próbie Rivalty wysięki tworzą charakterystyczny kłaczek połączony z powierzchnią roztworu (ryc. 5) (7).
Przydatnym badaniem w diagnostyce zakaźnego zapalenia otrzewnej jest ultrasonografia. Dzięki USG można zaobserwować obecność wolnego płynu w jamach ciała, zmiany w wątrobie, śledzionie, nerkach oraz limfadenopatię brzuszną. Może się zdarzyć, że wolnego płynu w jamie otrzewnej zgromadzi się na tyle mało, iż powiększony obrys jamy brzusznej nie będzie widoczny gołym okiem, dlatego USG stanowi istotny element w procesie rozpoznania zakaźnego zapalenia otrzewnej (6).
W diagnostyce FIP istotne jest spojrzenie na pacjenta w kontekście całego obrazu klinicznego, ponieważ nie zawsze występują odchylenia w wynikach rutynowych badań.
W procesie diagnostycznym, oprócz RT-qPCR, uwzględniono również wyniki wybranych badań laboratoryjnych i obrazowych, choć nie we wszystkich przypadkach wykonano pełen zakres analiz.
Do najczęściej ocenianych parametrów należały: liczba leukocytów (WBC), liczba erytrocytów (RBC), stężenie białka całkowitego (TP), poziom globulin (G), stosunek albumin do globulin (A/G), stężenie bilirubiny całkowitej (TB), a także wyniki badania ultrasonograficznego jamy brzusznej (USG). W przypadkach wystąpienia wolnego płynu w jamach ciała wykonano również próbę Rivalty w celu oceny charakteru płynu.
Dane zebrane podczas badań posłużyły do analizy korelacji objawów klinicznych, wyników badań dodatkowych oraz skuteczności zastosowania testu RT-qPCR jako narzędzia potwierdzającego diagnozę FIP.
Wyniki
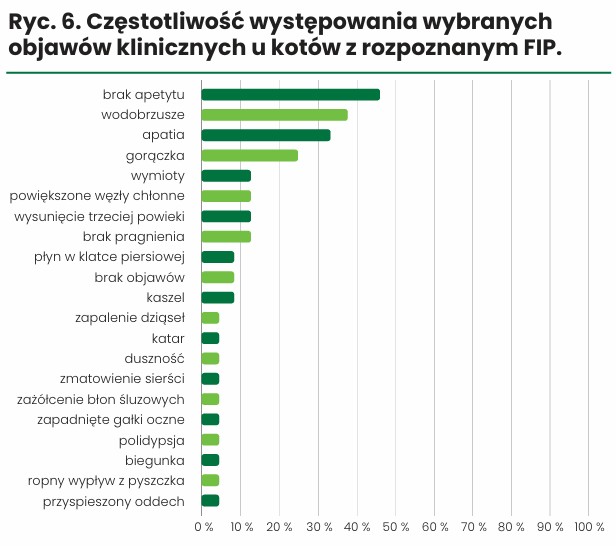
Spośród 50 kotów objętych analizą, u 24 rozpoznano FIP. W tej grupie postać wysiękową stwierdzono u 11 zwierząt, a bezwysiękową u 13. Osiem kotów miało ponad 3 lata. Obraz kliniczny charakteryzował się dużym zróżnicowaniem i niespecyficznością objawów (ryc. 6).
W analizowanej grupie kotów, u których istniało podejrzenie FIP, lekarze w różnym stopniu wykorzystywali dostępne narzędzia diagnostyczne. Badanie ultrasonograficzne wykonano w 31 przypadkach, morfologię krwi zlecono u 34 pacjentów. Stężenie białka całkowitego oceniono u 29 kotów, a oznaczenie globulin wraz z obliczeniem stosunku albuminy/globuliny przeprowadzono u 31 zwierząt. Poziom bilirubiny oznaczono u 25 kotów. Bezpośrednio po obszernym wywiadzie badanie PCR zlecono u 5 pacjentów.
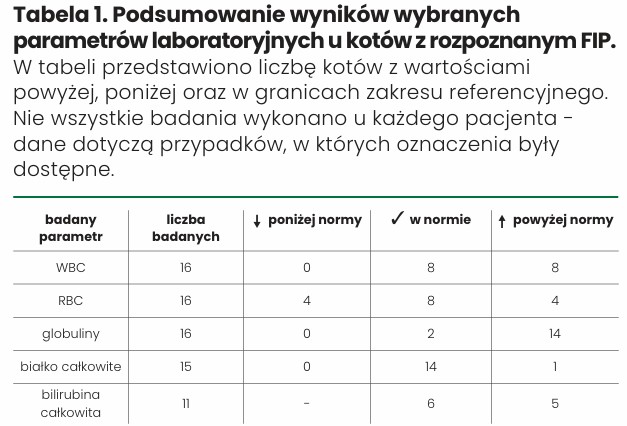
Spośród 24 kotów, u których rozpoznano FIP, wykonanie poszczególnych badań biochemicznych nie było możliwe u wszystkich pacjentów, co wynikało z ograniczeń praktyki klinicznej i retrospektywnego charakteru analizy. Ograniczenia te należy uwzględnić w interpretacji wyników. Mimo to uzyskane dane pozwalają zasygnalizować najczęstsze zmiany towarzyszące FIP i mogą stanowić punkt odniesienia w ocenie przypadków klinicznych. W tabeli 1 przedstawiono dostępne dane dla wybranych parametrów.
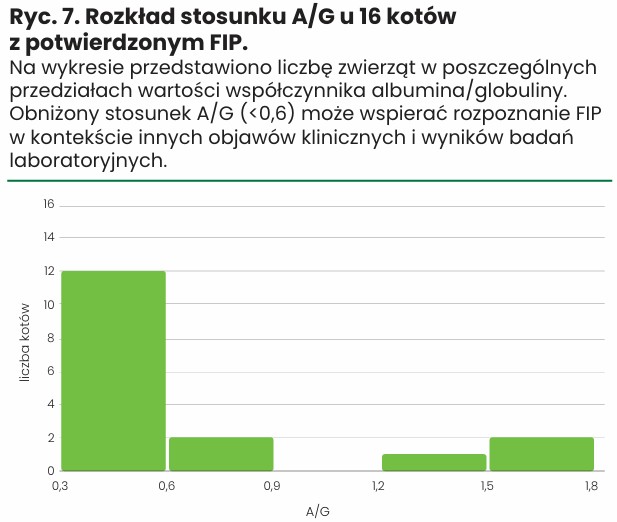
W celu przedstawienia rozkładu stosunku albuminy/globuliny (A/G) w badanej grupie pacjentów sporządzono wykres obrazujący częstość występowania poszczególnych wartości tego parametru (ryc. 7). Dane uzyskano dla 16 kotów, u których wykonano badania biochemiczne. Zakres referencyjny stosunku A/G dla kotów wynosi 0,6–1,2.
Dla każdego z przesłanych płynów z jam ciała u kotów z potwierdzonym FIP wykonano próbę Rivalty w celu oceny ich charakteru pod względem zawartości białka. Wszystkie analizowane próbki (8/8; 100%) dały wynik dodatni, co wskazuje na obecność wysięku o wysokiej zawartości białka.

Diagnostyka różnicowa
Wśród alternatywnych rozpoznań znalazły się między innymi chłoniak, kardiomiopatia przerostowa, niewydolność krążeniowa, niedomykalność zastawek, enteropatia, plazmocytarne zapalenie opuszek, a także przewlekłe schorzenia stomatologiczne, takie jak hiperplazja dziąseł.
U niektórych pacjentów obserwowano objawy neurologiczne (padaczka) lub przewlekłe infekcje górnych dróg oddechowych, w części przypadków będące następstwem wcześniejszej infestacji nicieniami płucnymi bądź infekcji wirusowych (np. kaliciwirus).
W kilku przypadkach zgłoszono jedynie badania kontrolne lub nie przeprowadzono dalszej diagnostyki, co uniemożliwiło postawienie jednoznacznego rozpoznania.
W ramach postępowania diagnostycznego stosowano również szereg badań uzupełniających, obejmujących testy serologiczne i molekularne w kierunku wirusa białaczki kotów (FeLV), wirusa niedoboru immunologicznego kotów (FIV) oraz Toxoplasma gondii. Dodatkowo wykonano badania histopatologiczne oraz parazytologiczne w kierunku Giardia spp. i nicieni płucnych.
Tak szeroki zakres diagnostyki umożliwił precyzyjne określenie przyczyny objawów klinicznych oraz wykluczenie innych potencjalnych jednostek chorobowych.
W jednym przypadku uzyskano wynik fałszywie ujemny w badaniu molekularnym (RT-PCR), wykonanym z wymazu bogatokomórkowego. Należy podkreślić, że tego rodzaju materiał nie jest optymalny do diagnostyki FIP ze względu na możliwość uzyskania niewiarygodnych wyników – szczególnie przy niskiej reprezentacji zakażonych makrofagów lub obecności licznych komórek tła, które mogą wpływać na skuteczność amplifikacji materiału wirusowego. Wynik ten podkreśla znaczenie właściwego doboru materiału biologicznego w kontekście diagnostyki molekularnej FIP.
Dyskusja
Przeprowadzona analiza potwierdza, że FIP pozostaje poważnym wyzwaniem diagnostycznym w praktyce klinicznej ze względu na niespecyficzne objawy oraz zmienność obrazu klinicznego. Pomimo zaawansowania metod diagnostycznych, w tym dostępności RT-qPCR, kluczowe znaczenie ma całościowa ocena pacjenta – obejmująca zarówno dane kliniczne, jak i wyniki badań laboratoryjnych oraz obrazowych.
Zastosowanie RT-qPCR umożliwiło precyzyjne potwierdzenie obecności zmutowanego szczepu FCoV II u pacjentów z podejrzeniem zakaźnego zapalenia otrzewnej, co potwierdza skuteczność tej metody jako elementu decyzyjnego w algorytmie diagnostycznym. Szczególną uwagę należy zwrócić na właściwy dobór materiału do badania – przypadek fałszywie ujemnego wyniku pokazuje, że bogatokomórkowe wymazy z dróg oddechowych nie zawsze są optymalne i mogą prowadzić do błędnych interpretacji.
W doborze materiału do badania należy uwzględnić obszary, w których objawy manifestują się najsilniej.
Istotnym wskaźnikiem wspierającym rozpoznanie FIP okazał się obniżony stosunek albumin do globulin (A/G < 0,6), obserwowany u znacznej części pacjentów. Podobnie wysoki poziom globulin oraz dodatni wynik próby Rivalty w płynie z jam ciała stanowiły ważne przesłanki diagnostyczne. Mimo to niektóre koty prezentowały parametry w normie lub jedynie nieznacznie odbiegające od wartości referencyjnych, co dodatkowo komplikuje postępowanie diagnostyczne i wskazuje na konieczność uwzględniania całokształtu informacji klinicznych.
Warto podkreślić, że objawy FIP mogą obejmować różne układy – od objawów neurologicznych, przez zmiany okulistyczne, aż po symptomy ogólne, takie jak apatia czy spadek masy ciała. Dlatego nie można opierać diagnozy wyłącznie na pojedynczym parametrze laboratoryjnym czy objawie klinicznym.
W badanej grupie zdiagnozowano FIP u kotów w różnym wieku – nie tylko u młodych, co może świadczyć o szerszym spektrum ryzyka niż dotychczas zakładano. Obserwacja ta powinna skłonić lekarzy do brania pod uwagę FIP także u starszych osobników.
Wnioski
- RT-qPCR jest cennym narzędziem w diagnostyce FIP, jednak jego skuteczność w dużej mierze zależy od odpowiedniego doboru materiału biologicznego oraz jakości próbki.
- Stosunek A/G < 0,6 oraz hipergammaglobulinemia mogą wspierać rozpoznanie FIP, zwłaszcza w kontekście innych wyników badań i objawów klinicznych.
- Żaden z badanych kotów z potwierdzonym FIP nie miał wartości A/G mieszczącej się w zakresie referencyjnym (0,6–1,2), co potwierdza histogram rozkładu tego parametru i podkreśla jego wysoką wartość diagnostyczną.
- Stosunek A/G > 1,2 obserwowano wyłącznie u zwierząt bezobjawowych, co może wskazywać na wczesne lub nietypowe stadium choroby. Takie przypadki pokazują, że prawidłowy lub nawet podwyższony współczynnik A/G nie wyklucza FIP i nie powinien być traktowany jako jedyny parametr diagnostyczny.
- Dodatni wynik próby Rivalty w płynach z jam ciała stanowi przydatne badanie pomocnicze, wskazujące na wysięk typowy dla FIP.
- Ze względu na różnorodność objawów oraz możliwość ich nakładania się z innymi jednostkami chorobowymi, rozpoznanie FIP powinno być oparte na kompleksowej analizie obrazu klinicznego, badań laboratoryjnych, obrazowych oraz wyników molekularnych.
- FIP może występować także u starszych kotów, co powinno skłonić lekarzy do uwzględniania tego rozpoznania niezależnie od wieku pacjenta.
- Ostateczne rozpoznanie powinno być zawsze efektem integracji wyników wielu badań, a nie polegać wyłącznie na pojedynczym teście diagnostycznym.
Bibliografia
- Adaszek Ł., Kalinowski M., Rutkowska M., Mazurek Ł.
Comparison of the sensitivity of rapid tests, FCoV Ab (Vet Expert) and PCR, in the diagnosis of feline infectious peritonitis (FIP) in cats with the effusive form of the disease. Veterinary Medicine, 2023, 79(2): 6745–2023. - Cook A. K., Nelson W. R.
Feline infectious peritonitis: strategies for diagnosing and treating this deadly disease in young cats. Veterinary Medicine, 2013, 108(9): 430. - Dunbar D., Kwok W., Graham E., Armitage A., Irvine R., Johnston P., McDonald M., Montgomery D., Nicolson L., Robertson E., Weir W., Addie D. D.
Diagnosis of non-effusive feline infectious peritonitis by reverse transcriptase quantitative PCR from mesenteric lymph node fine-needle aspirates. J. Feline Med. Surg., 2019, 21: 910–921. - Emmler L., Felten S., Matiasek K., Balzer H. J., Pantchev N., Leutenegger C., Hartmann K.
Feline coronavirus with and without spike gene mutations detected by real-time RT-PCRs in cats with feline infectious peritonitis. J. Feline Med. Surg., 2020, 22(8): 791–799. - Gliński Z., Kostro K. i in.
Choroby zakaźne zwierząt z elementami epidemiologii zoonoz. PWRiL, Warszawa, 2011: 387–391. - Pedersen N. C.
An update on feline infectious peritonitis: diagnostics and therapeutics. Vet. J., 2014, 20: 133–141. - Tasker S.
Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. J. Feline Med. Surg., 2018, 20: 228–243. - Tekes G., Thiel H. J.
Feline coronaviruses: pathogenesis of feline infectious peritonitis. Adv. Virus Res., 2016, 96: 193–218. - Thayer V., Gogolski S., Felten S., Hartmann K., Kennedy M., Olah G. A.
2022 AAFP/EveryCat Feline Infectious Peritonitis Diagnosis Guidelines. J. Feline Med. Surg., 2022, 24(9): 905–933. - Zhu J., Deng S., Mou D., Zhang G., Fu Y., Huang W., Zhang Y., Lyu Y.
Analysis of spike and accessory 3c genes mutations of less virulent and FIP-associated feline coronaviruses in Beijing, China. Virology, 2024, 589: 109919.
Autor korespondencyjny:
Maja Stekel
e-mail: [email protected]

